להחזיר את הגלגל: תאי גזע עובריים מושרים
תאים בעלי תכונות של תאי גזע עובריים המיוצרים במעבדה מתאים "רגילים" יכולים לשמש למגוון רחב של מחקרים. התקווה היא שתאים אלה יוכלו לשמש בעתיד גם לריפוי בני אדם
לתאי גזע עובָּריים יש שימושים פוטנציאליים רבים ברפואה ובמחקר, אולם הפקה של תאי גזע עובריים כרוכה בקשיים רבים, הן מבחינה טכנית והן מבחינה אתית. נוסף על כך, במקרים רבים החוקרים היו מעדיפים להפיקם מחולה ספציפי, כדי להימנע מדחייה חיסונית. בשנים האחרונות חלה התקדמות משמעותית בתחום. החוקרים היפנים טקהשי ויאמאנאקה (Takahashi, Yamanaka) הראו ב־2006 שאפשר לקחת מאדם בוגר תאים בוגרים (תאים שעברו התמיינות), ולהעביר אותם תהליך של "תכנות מחדש" (Reprogramming), ולקבל תאים הדומים בתכונותיהם לתאי גזע עובריים. תאים אלה מכונים "תאי גזע עובריים מושרים" (iPSCs, תגע"מים; בעברית מכנים אותם לעתים קרובות "תאי גזע מושרים"). בשנים שעברו מאז נעשו התפתחויות משמעותיות בתחום, בעיקר בשיפור הטכניקה ובמחקר, והתקווה הגדולה היא שתאים אלה יוכלו לשמש בעתיד גם לריפוי בני אדם.
התאים הם היחידות התפקודיות הבסיסיות של הגוף. גודלם של התאים בגופנו מיקרוסקופי; בדרך כלל קוטרם עשרות מיקרומטר ואף פחות מכך. מספר התאים בגוף האדם נאמד בעשרות טריליונים (טריליון פירושו אלף מיליארדים), ובהם מבחינים בכ־220 סוגי תאים (למשל תאי דם שונים, תאי עצב, תאי שריר, וכו'). כל טריליוני התאים בגוף, לסוגיהם השונים, מקורם בתא אחד יחיד – הביצית המופרית. תאים מתרבים בדרך של חלוקה, בדרך כלל מתא אֵם אחד לשני תאי בת. כאשר תא עובר תהליך של שינוי משמעותי ב"אופי" שלו – מסוג תא מסוים לסוג תא אחר, התהליך מכונה "התמיינות" (Differentiation). ההתמיינות מהביצית המופרית לכל סוגי התאים נעשית בשלבים, ובעיקרון מדובר בתהליך חד כיווני, ללא חזרות לאחור. כלומר, תאים שהחלו תהליך של התמיינות, למשל בכיוון של תאי דם, יכולים להתמיין בגוף לתאי הדם השונים בלבד, ולא לתאי עצב או לתאי שריר. השינויים הללו נעשים על ידי שינויים ברמות הביטוי של גנים. אף שבכל תא ותא בגופנו יש אותו מטען גנטי (דנ"א), הביטוי של הגנים, כלומר יצירת מולקולות רנ"א תואמות, ותרגומן לחלבונים, משתנה בין תא לתא, בהתאם לתוכנית ההתפתחותית ובהתאם לסביבה.

צילום: אימג'בנק
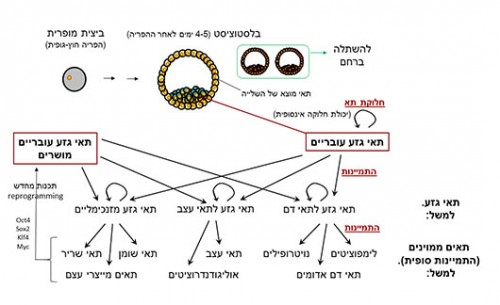
תאי גזע הם תאים המתייחדים בשתי תכונות עיקריות: יכולת התמיינות לכמה סוגים של תאים, ויכולת חלוקה אינסופית (בניגוד לתאים אחרים שמתים אחרי כמה עשרות חלוקות). תאי גזע עובריים (ESCs) הם תאים הנוצרים בשלב מוקדם מאוד בהתפתחות העוברית (כ־4־5 ימים לאחר ההפריה, בשלב הבלסטוציסט), ויש להם את היכולת להתמיין לכל סוגי התאים בגוף (תאים פלוריפוטנטיים). מדובר בתאים קטנים ו"פשוטים" יחסית (צורה עגולה, ללא תפקוד מיוחד בגוף, מלבד חלוקה והתמיינות), ובעלי קצב חלוקה גבוה. לעומתם, תאי גזע "בוגרים" (תאים מולטיפוטנטיים), הנוצרים בשלבים מתקדמים יותר, הם תאים שעברו כבר התמיינות בכיוון מסוים, וכעת יכולים לתת מוצא למערך מוגבל יותר של תאים. כך למשל תאי גזע של מערכת הדם, הנמצאים במח העצם, יכולים ליצור את כל סוגי תאי הדם (תאי דם אדומים, תאי מערכת החיסון, ועוד), אך לא תאים אחרים בגוף.
תאי מעבדה
אפשר להפיק תאי גזע עובריים מעוברים "עודפים" הנוצרים ב"הפריית מבחנה" (IVF). בדרך כלל בתהליך זה ישנה התפתחות ראשונית של יותר עוברים ממה שמעוניינים להשתיל ברחם, ובמקום להקפיא או להשמיד את העודפים, אפשר להשתמש בהם למחקר (בהסכמה כמובן). את תרבית התאים המופקת אפשר בעיקרון להמשיך ולגדל במעבדה לנצח, בתנאים מתאימים. מבחינה תיאורטית אפשר במעבדה להביא להתמיינות תאי גזע עובריים לכל סוג תא שהוא, אם מוצאים את ההליך (הפרוטוקול) המתאים. מעשית פותחו כבר פרוטוקולים למיון במעבדה לכיוונים שונים (למשל – לתאי דם שונים, לתאי עצב, לתאי כבד ועוד).
יש חשיבות רפואית ומחקרית לאפשרות להשרות באופן מלאכותי התמיינות של תאי גזע עובריים לתאים מסוגים שונים. למשל, באבחון גנטי טרום השרשתי (PGD) בהפריות חוץ גופיות ("הפריות מבחנה") מזהים עוברים "חולים" (בעלי הפגם הגנטי הנבדק), וכך נמנעים מהשתלתם ברחם. אפשר להשתמש בתאי גזע עובריים המופקים מהם לצורך חקר המחלה הרלוונטית. כך למשל, אם נרצה לחקור את מחלת ניוון השרירים ALS, נוכל להיעזר בתאי גזע עובריים עם מוטציה רלוונטית וננסה לגרום להם להתמיין במעבדה לתאים הרלוונטיים, במקרה זה תאי עצב.
איור: אביחי רן
אך לצורך טיפול רפואי, כלומר לצורך השתלות, יש צורך בתאי גזע עובריים שלא יידחו על ידי מערכת החיסון. לשם כך טוב שתהיה דרך כלשהי לקחת תאים מהחולה עצמו ולהפיק מהם תאי גזע עובריים. אך כאמור, תאים אלו קיימים רק בימים הראשונים של ההתפתחות העוברית, ותהליכי ההתפתחות וההתמיינות בטבע הם בעיקרם חד כיווניים. והנה, מתברר שבאופן מלאכותי אפשר לעשות תהליך של "חינוך" או "תכנות" מחדש (Reprogramming) של תאים ממוינים. אחת הדרכים לעשות זאת היא על ידי שיבוט (Clonning). בתהליך זה מוציאים את הגרעין של תא בוגר (תא סוֹמָטי) כלשהו, ומחדירים אותו לתא ביצית שממנו הוצא הגרעין. כך מתקבל תא שבו המידע הגנטי הוא של התא הבוגר עם הסביבה ה"עוברית" של תא הביצית. אם אכן יתפתח מתא זה עובר, הוא יהיה (כמעט) זהה גנטית ליצור שממנו נלקח גרעין התא הסומטי. כך למשל הכבשה המפורסמת דולי הייתה מעין תאומה זהה של הכבשה שתרמה את התא סומטי (תא מהעטין), ולא היה לה (כמעט) מטען גנטי שמקורו בכבשה שתרמה את הביצית, וודאי שלא בכבשה שנשאה אותה ברחמה. תהליך דומה ביצע החוקר ג'ון גורדון (Gurdon) כבר ב־1962 עם צפרדעים. בכך הוא הוכיח לראשונה שבתנאים מסוימים התמיינות תאים יכולה להיות הפיכה, ושבגרעין של תא בוגר ממוין (תא סומטי) קיים כל המידע הדרוש להתפתחות בעל החיים השלם, כאשר הביצית מספקת את הסביבה המאפשרת זאת. אך תהליך השיבוט הוא מסובך וקשה מאוד מבחינה טכנית ואתית. נוסף על כך, כיוון שהמקור הגנטי לשיבוט הוא גרעין תא בוגר, ישנה בעיה של הזדקנות תאית מואצת ביצורים המשובטים. לכן היה צורך בשיטה כלשהי שתאפשר הפקת תאי גזע עובריים מתאים בוגרים באופן ישיר, ושתחקה את התכנות מחדש שעוֹברים תאים בוגרים בתהליך יצירת תאי המין.
כאמור, השיטה פותחה לראשונה ב־2006, במעבדה של שיניה יאמאנאקה (Yamanaka) באוניברסיטת קיוטו שביפן. את המחקר הוביל תלמידו קאזוטושי טקאהאשי (Takahashi). החוקרים לקחו תאי עור מעכבר בוגר, גידלו אותם בתרבית, והשתמשו בשיטות של הנדסה גנטית כדי להחדיר ולבטא בהם ארבעה גֶנים: Oct4, Sox2, Klf4 ו־Myc. לגנים Oct4 ו־Sox2 חשיבות בשמירת הפלוריפוטנטיות של תאי גזע עובריים (כלומר, מניעת ההתמיינות הראשונית שלהם). הגנים Klf4 ו־Myc ידועים כגנים שרמת הביטוי שלהם עולה לעתים קרובות בגידולים סרטניים. נוסף על כך, גם להם יש חשיבות בשמירת הפלוריפוטנטיות של תאי גזע עובריים, וכן בשמירת קצב החלוקה הגבוה של תאים אלה בתרבית. כמה שבועות לאחר החדרת הגנים, אחוז קטן מהתאים שהתקבלו החלו להראות מאפיינים של תאי גזע עובריים. אפשר היה למיין אותם לסוגי תאים מגוונים, ואפילו ליצור עכברים שלמים שמקורם בתאים אלה; אפשר היה להמשיך ולגדל אותם בתרבית "לנצח"; המורפולוגיה שלהם הייתה דומה לזו של תאי גזע עובריים; והיה בהם ביטוי של גנים אופייניים לתאי גזע עובריים. תאים אלו כונו באנגלית Induced Pluripotent Stem Cells, או בקיצור תאי IPS או IPSCs, ואנו יכולים לכנות אותם 'תאי גזע עובריים מושרים' (תגע"מים). עבור תגלית זו קיבל יאמאנאקה פרס נובל לרפואה לשנת 2012 יחד עם ג'ון גורדון. ב־2007 פרסמו חוקרים מאותה המעבדה כי הצליחו באותה שיטה להפיק תגע"מים גם מתאי אדם.
צילום: שאטרסטוק
הנדסה גנטית וריפוי עכברים
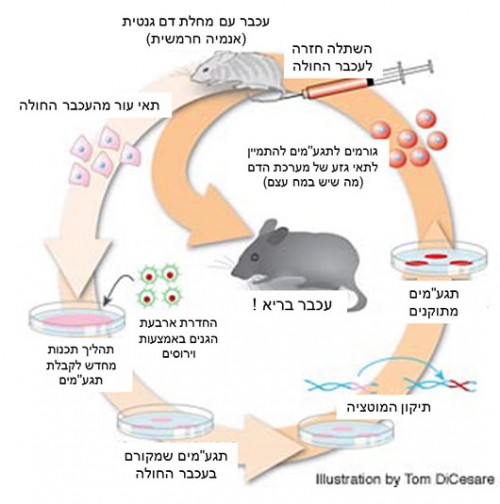
מחקרים אלה סללו דרך למחקרים רבים בתחום, מתוך שאיפה שתהליך התכנות מחדש והשימוש בתגע"מים יחליף את הצורך בתאי גזע עובריים "אמיתיים" (מהפריות מבחנה למשל), או תאי גזע עובריים שמקורם בשיבוט. כבר ב־2007 פורסם מחקר שבו הצליחו החוקרים לרפא באמצעות תגע"מים עכברים החולים במחלת דם תורשתית (אנמיה חרמשית). את המחקר הוביל חוקר ישראלי בשם יעקוּבּ חנא במעבדתו של רודולף ג'ייניש (Jaenisch) בקיימברידג' שבארצות הברית. החוקרים לקחו תאי עור מעכברים חולים, והשתמשו בארבעת הגנים הנ"ל כדי לעשות להם תכנות מחדש לקבלת תגע"מים. לאחר מכן הם השתמשו בשיטות של הנדסה גנטית כדי לתקן בתגע"מים את המוטציה הרלוונטית. החוקרים גרמו לתאים המתוקנים להתמיין במעבדה עד לקבלת תאי גזע של מערכת הדם, שאותם השתילו בעכבר החולה, שהחלים בעקבות כך מהמחלה. התאים המושתלים היו תאים שמקורם בעכבר החולה עצמו, מה שמנע דחייה חיסונית. מחקר זה מהווה הוכחה עקרונית (Proof of Concept) שאפשר להשתמש בתגע"מים גם לריפוי מחלות, ולא רק למחקר. כך למשל ייתכן ששיטות דומות בעתיד ישמשו לריפוי מחלות דם תורשתיות, לריפוי של סרטן דם (לוקמיה), או לריפוי של מחלות נוירולוגיות שונות – באמצעות השתלת תגע"מים שמקורם בתאים של החולה עצמו.
אך שיטות התכנות מחדש לקבלת תגע"מים נתקלו, ונתקלות עדיין, בכמה מכשולים. יעילות השיטה עדיין נמוכה – אחוז התאים שהופכים בפועל לתגע"מים נמוך בדרך כלל, והזמן לקבלתם ארוך יחסית (כמה שבועות). כמו כן השימוש בהחדרת גנים זרים עלול לגרום לתופעות לוואי, משום שלא בטוח היכן בגנום הם ייכנסו ואם יפריעו לפעולת גנים אחרים – דבר המגביר סיכון לסרטן ולבעיות אחרות. נוסך על כך, יש הבדל ניכר בין תוצאות התהליך בתאי אדם ביחס לתאי עכבר, וכן נותר "זיכרון" מסוים בתגע"מים של תאי המוצא שלהם, כך שיותר קשה למיין אותם לכיוון של תאים מסוג אחר. כל אלו נוספות לבעיות שונות אחרות.
מאז פריצות הדרך ב־2006־2007 נעשו ניסיונות רבים לשיפור השיטה. למשל, חוקרים הראו שאפשר לבצע את התהליך גם ללא החדרת דנ"א לתאים, באמצעות החדרה של החלבונים שהם תוצרי אותם ארבעת הגנים הרלוונטיים, או באמצעות הרנ"א-שליח (mRNA) שלהם. נזכיר כי ביטוי גנים נעשה על ידי תעתוק של הגן מהדנ"א לרנ"א-שליח (mRNA), המתורגם לחלבון. נוסף על כך, נעשו ניסיונות "לשחק" עם הֶרכב הגנים המוחדרים, כך שיקטן הסיכון לסרטן (למשל על ידי הורדת פעילות הגן Myc, אשר ביטוי יתר שלו עשוי לעודד היווצרות סרטן).
תהליכים אפיגנטיים
אחת המעבדות המובילות בתחום היא מעבדתו של ד"ר חנא במכון ויצמן. מחקרים שבוצעו בה בשנים האחרונות שיפרו באופן ניכר את הבנת התהליך ואת יעילות השיטה. ב־2012 פרסמו חוקרי המעבדה מאמר השופך אור על התהליכים האפיגנטיים המתרחשים בתהליך, ועל חשיבותו של האנזים Utx, המופעל בתהליך התכנות מחדש. הכוונה ב"תהליכים אפיגנטיים" היא שינויים ביוכימיים שונים המשפיעים על צפיפות אריזת מולקולות הדנ"א בגרעין, שבכך משפיעים על בקרת ביטוי הגנים בתא (אריזה צפופה יחסית של אזור מסוים בדנ"א תאפשר פחות גישה לגורמי תעתוק ולכן תביא לירידה בביטוי הגן או הגנים באזור הרלוונטי). השינויים (המודיפקציות) העיקריים בהקשר זה הם מתילציה של דנ"א ושינויים שונים בהיסטונים, החלבונים שסביבם כרוך הדנ"א בגרעין. יש שינויים ניכרים בסַמנים האפיגנטיים בתהליכי התמיינות שונים, ובמהלך יצירת תאי המין יש מעין "אתחול מחדש" שלהם. אתחול מחדש דומה, חלקי לפחות, מתרחש גם בתהליך התכנות מחדש המלאכותי. כך למשל, האנזים Utx מתפקד כמסיר מתילציה מחומצה אמינו ספציפית בהיסטון ספציפי (H3K27); האנזים מסיר קבוצות מתיל, ובכך משפיע על ביטוי הגנים הרלוונטיים.
ב־2013 פרסמה קבוצתו של חנא, בשיתוף פעולה עם קבוצות מחקר אחרות, שני מחקרים בתחום במגזין Nature. בשניהם תיארו החוקרים שיפורים בשיטה הקיימת של התכנות מחדש לקבלת תגע"מים. באחד המחקרים הוגדרו תנאים שבהם מושגים תגע"מים "אמיתיים" יותר. כלומר, בעלי תכונות המזכירות יותר תאי גזע עובריים אמיתיים, המופקים כאמור מעוברים בני 4־5 ימים, בשלב שלפני ההשרשה ברחם. מצב זה מכונה "מצב תמים" (Naive), בניגוד למצב המתפתח לאחר ההשתרשות ברחם, המכונה מצב "ראשוני" או "מופעל" (Primed). בשיטה ה"קלאסית" (יאמאנאקה, 2006) המצב הנאיבי מושג יותר בתגע"מים מתאי עכבר ופחות מתאי אדם. המחקר השני התמקד בגן Mbd3, הפועל, כך מתברר, כבלם לתהליך. החוקרים הראו שגן זה, הפעיל באופן רגיל רק בימים הראשונים של ההתפתחות העוברית, עובר הפעלה מחדש בתהליך התכנות מחדש. החלבון הנוצר מגֶן זה מתפקד, עם חלבון נוסף, NuRD, כמעכב של ביטוי גנים – אותם גנים המופעלים על ידי ארבעת הגנים של התכנות מחדש, ואשר חיוניים להצלחת התהליך ולשמירה על המצב הפלוריפוטנטי (מצב שבו אפשרית עדיין ההתמיינות לכל סוגי התאים). כאשר ביצעו החוקרים את תהליך התכנות מחדש עם תאי מקור שבהם חסר גן זה (Mbd3), בתוספת התנאים המשופרים שתוארו במחקר האחר, הם קיבלו שיפור ניכר ביעילות השיטה – מאחוזי הצלחה בודדים לקרוב ל־100 אחוז הצלחה (!), ומתהליך הדורש כשלושה שבועות ויותר, לתהליך הנמשך כשבוע בלבד.
מחקר מעניין נוסף פורסם במגזין Nature Methods ב־2014. את המחקר הוביל החוקר הישראלי אורי בר נור (Ori Bar-Nur) במעבדה של קונרד הוכדלינגר (Hochedlinger) באוניברסיטת הרווארד. החוקרים הראו שאפשר להשתמש במולקולות קטנות מסוימות כדי לשפר את התהליך, גם מבחינת הזמן (ימים בודדים) וגם מבחינת אחידות התהליך. שני החומרים שבהם השתמשו הם חומצה אסקורבית (ויטמין C), וחומר בשם AGi, המשמש כמעכב של האנזים GSK3b.
איור: MIT/ Tom DiCesare / עריכת עברית: אביחי רן
בשנים האחרונות בוצעו בתחום התגע"מים עוד מחקרים מעניינים רבים. ב־2008 חוקרים ממכון סאלק שבסן דייגו הצליחו להפיק תגע"מים משערה אנושית בודדה (!); ב־2012, חוקרים בראשותו של הרואיסה אינו (Inoue) מאוניברסיטת קיוטו שביפן לקחו תאים בוגרים ממוינים משלושה חולים במחלת ALS, שלכולם מוטציה באותו גן, ועשו להם תכנות מחדש ליצירת תגע"מים. לאחר מכן גרמו להם להתמיין מחדש ליצירת תאי עצב, ונעזרו בהם לחקר המחלה; ב־2013, חוקרים מאוניברסיטת רוצ'סטר שבניו יורק הפיקו תגע"מים מאדם, גרמו להם להתמיין לתאי מוח מייצרי מיאלין, והשתילו אותם בעכברים (המיאלין הוא המעטפת המבודדת של תאי העצב, הנפגעת במחלת טרשת נפוצה, MS); במחקר אחר מ־2012 נלקחו תאי עור של חולה בניוון מקולרי, מחלה הגורמת לפגיעה קשה בראייה, ועברו תהליך של תכנות מחדש לתגע"מים. אלו מוינו לתאי רשתית, הושתלו בעכברים, ושיפרו את ראייתם; במחקר שפורסם ב־2011, חוקרים מהטכניון הפיקו תגע"מים מתאי עור של חולים במחלת הפרעת הקצב הלבבית CPVT, הנגרמת אצלם בשל מוטציה. את התגע"מים נושאי המוטציה הצליחו למיין לתאי לב פועמים. כך יכלו לחקור את המחלה וכן לבחון תרופות פוטנציאליות; חוקרים מאוניברסיטת יוקוהאמה ביפן אף הראו, במחקר שפורסם בכתב העת Nature ב־2013, כי אפשר להפיק מעין כבד מתפקד שמקורו בתגע"מים. החוקרים יצרו במעבדה תגע"מים מאדם, והצליחו לגרום להם להתמיין לשלושה סוגי תאים החיוניים להתפתחות הכבד. תאים אלה עורבבו יחד, הושתלו בעכברים ושימשו כ"נבטים" למשיכת כלי דם למקום וליצירת איבר דמוי כבד מתפקד בעכברים.
אפשר לתאר את תהליך יצירת תאי הגזע העובריים המושרים כמעין "חינוך מחדש" ביולוגי במעבדה. התוכנית ההתפתחותית הרגילה בטבע היא חד כיוונית בעיקרון, כאשר בכל שלב "לומדים" התאים משהו חדש, ונהיים יותר ויותר מחויבים לתפקידם הסופי הספציפי בגוף. בתהליך יצירת תאי המין ישנו איפוס של כל זה, ובביצית המופרית הכל מתחיל מחדש. תהליך התכנות מחדש המלאכותי במעבדה דומה לאותו אתחול מחדש. כאשר מוסיפים לכך את היכולת לגרום לתגע"מים להתמיין לסוגי תאים שונים, אפשר לראות את התהליך כולו – מתאים בוגרים, דרך תגע"מים, וחזרה לתאים בוגרים מתוקנים או מסוג אחר – כמעין חינוך מחדש של התאים הללו. תחום זה התפתח מאוד במעט השנים שעברו מאז ראשיתו במחקר של יאמאנאקה ב־2006. כרגע הוא משמש בעיקר כמודל מחקר מרכזי עבור מחלות רבות. השאלה הגדולה היא אם בעתיד הלא כל כך רחוק נזכה לראות גם את היישום הרפואי של תחום מרתק ומבטיח זה.

