גמד טכנולוגי בשירות הרפואה
ננו טכנולוגיה מעוררת בשנים האחרונות סקרנות ועניין רב. חלקיקים בגודל של עשרות ננומטרים יכולים לחולל שינויים גדולים בגופנו. מהו אותו עולם קטן, וכיצד אפשר להיעזר בו בתחום הרפואה?
השם ננוטכנולוגיה מייצר הרבה רעש בסביבת שומעיו בשנים האחרונות, ונראה כי הגיע הזמן לפזר את העשן שמסביבו ולקחת את הקורא הנבוך למסע קסום אל העולם ה"קטן". ננסה לעשות זאת כאן מבעד לעינה של המעבדה לננו־רפואה באוניברסיטת תל־אביב.
כדי להמחיש את גודל עולם הננו נאמר שבנקודה בסוף משפט זה ייכנסו מיליון חלקיקים בגודל של עשרות ננומטרים כל אחד, היכולים לחולל שינויים מרחיקי לכת בגופנו. שערותכם סומרות? גודל החלקיקים קטן פי 1,000 מעובי שערה בגופנו (עובייה הוא 100 אלף ננומטר).
קצת היסטוריה: ב־1905, פאול ארליך (Ehrlich), מדען ורופא יהודי ממוצא גרמני, פרסם את כדור הקסם. ארליך הניח כי אם יהיה אפשר להכין תרכובת, שאותה כינה כדור קסם, שבאופן סלקטיבי תכוון נגד אורגניזם מחולל מחלה כגון חיידק, אפשר יהיה לקשור לתרכובת זו רעלן שיכוון נגד אותה מטרה ספציפית, יגיע עד אליה וישמיד אותה, אך לא יפגע בתאים בריאים מסביב. ארליך זכה בשנת 1908 בפרס נובל לרפואה על מחקריו החשובים בתחום החיסון, האוטואימוניות, וניסויים שביצע אשר הוכיחו לראשונה את קיומו של מחסום דם מוח. כדורי הקסם של ארליך מהווים את הבסיס לננו־רפואה המודרנית: טיפול באמצעות "תרופות חכמות" המסוגלות להתמקד ולהתביית על רקמות או תאים ספציפיים.
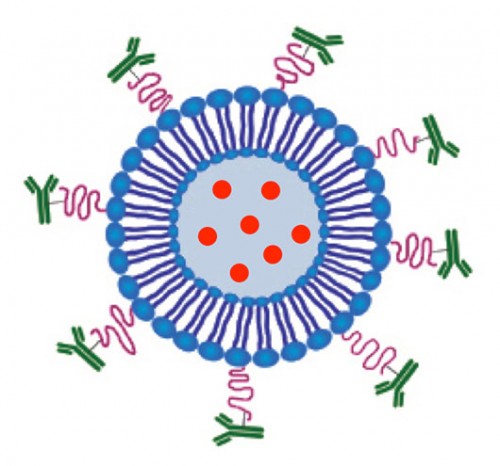
במעבדה לננו־רפואה באוניברסיטת תל־אביב מכינים ומאפיינים חלקיקים שונים העשויים מחומרי טבע כגון שומנים וסוכרים. דוגמה לחלקיקים כאלה הם ליפוזומים. אלו הם כדורונים זעירים הבנויים מסוגי שומן שונים, בקוטר של עשרות עד מאות ננומטרים. חלקיקים אלו יכולים לשמש כנשאי תרופות וחומרי דימות לצורך פיענוח וטיפול במחלות כגון סרטן; מחלות דלקתיות של המעי, כגון מחלת קרוהן וקוליטיס; מחלות נוירודגנרטיביות כגון פרקינסון ואלצהיימר; ומחלות נגיפיות שונות, כגון איידס.
בליפוזומים אפשר לכלוא למשל תרופות המיועדות לטיפול בסרטן, כמו כימותרפיה. בתהליך יצירת הליפוזומים טרם הפיכתם לכדורונים, אפשר להוסיף את המטען הרצוי, כגון תרופה, ולכלוא אותו בליבת החלקיקים, שם היא תישאר לאורך זמן, מיוצבת ומוגנת על ידי המעטה השומני.
היכן היתרונות?
טיפול כימותרפי כבר קיים; אם כך איפה החדשנות בננו־רפואה? ומה היתרונות שלה? כימותרפיה כפי שהיא כיום, ניתנת בהזרקה לתוך הווריד וכך היא מגיעה עם זרם הדם לכל מקום בגוף (טיפול סיסטמי). היתרון בטיפול סיסטמי (דרך זרם הדם) הוא שהתרופה מגיעה ומשפיעה גם על תאים שניתקו מהגידול, ועוברים דרך זרם הדם ומערכת הלימפה – תאים אלה יכולים לנדוד בגוף, להתיישב באיברים כמו הריאות והכבד וליצור גרורות. החיסרון במתן של תרופה סיסטמית הוא שרק אחוז קטן מאוד (פחות מאחוז אחד) מכלל התרופה המוזרקת מגיע בסופו של דבר לתאי הסרטן ומשפיע עליהם – הרוב מתפזר בגוף, גורם לתופעות לוואי קשות ופוגע גם בתאים בריאים. בניגוד לתרופה החופשית, התרופה הכלואה בתוך הליפוזומים אינה מתפזרת באופן חופשי בגוף עד להגעתה ליעד – שהוא התא הסרטני. לכן התרופה הכלואה בחלקיק אינה גורמת להרג תאים "חפים מפשע" ומצמצמת באופן ניכר את תופעות הלוואי הקשות. עם זאת החלקיקים יזהו את תאי הסרטן גם בסביבת הגידול, וגם יזהו את התאים אשר ניתקו מהגידול (הגרורות), וישחררו את התרופה הכלואה שבתוכם בסביבת הגרורות, כך שהיא תחדור אל תוך התא הסרטני ותשמיד אותו.
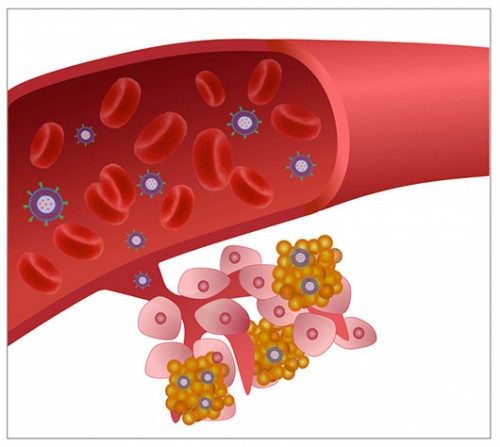
הכיצד? הכרת הגידול על ידי מערכת נשאי התרופות החלקיקיים יכולה להיעשות באחת משתי דרכים: פסיבית ואקטיבית. לתאים המרכיבים את הגידול מאפיינים ייחודיים משלהם. כדי לשגשג ולגדול בצורה בלתי מבוקרת צריכים חלק מסוגי הגידולים הסרטניים ליצור רשת כלי דם חדשה שתזין אותם. כלי הדם שנוצרים ומסתעפים בסביבת הגידול שונים במבנה שלהם מכלי דם רגילים, ובכך מתאפשרת חדירות שונה למעבר חומרים, בעיקר למולקולות גדולות. במצב זה החדירות גבוהה יותר מחדירותם של כלי הדם בסביבת תאים רגילים, זאת כדי לאפשר חילוף חומרים מהיר יותר, הנדרש להתבססותו של הגידול וליכולתו לשגשג. חדירותם הגבוהה של כלי דם בסביבת הגידול מאפשרת כניסה יעילה יותר של מולקולות גדולות, ובכללן תרופות, לגידולים מסוימים, ביחס לקצב כניסתן לתאים נורמליים. החלקיקים הנושאים את התרופה ינדדו בזרם הדם, יגיעו לסביבת הגידול ויאטו שם, כיוון שבמקום זה הגידול לוחץ על כלי הדם. הם יחדרו לכלי הדם בסביבת הגידול בצורה יעילה ומהירה יותר ביחס לכלי דם בסביבת תאים בריאים, המעטפת השומנית תתפרק באזור שבו נתקע החלקיק, והתרופה תפעפע מחוץ לחלקיק ותחדור לתאים הסרטניים. תהליך שחרור התרופה מתוך החלקיק יכול לקחת כמה ימים עד כמה שבועות, עד לפירוק חלקי או מלא של מעטפת החלקיק – והוא תלוי בן היתר בהרכב הכימי של החלקיק, בסוג התרופה ובאינטרקציה בין השניים. לעומת זאת, במקרה של תרופה חופשית, מדובר באירוע חד פעמי המתרחש בפרק זמן קצר מאוד של שניות ספורות, שבו חלק קטן מאוד מהתרופה חולף על פני תאי הגידול וחודר לתוך התאים. התרופה ממשיכה ברובה לזרום בכלי הדם ולחדור לתאים אחרים, לאו דווקא תאי הסרטן; חלקה מתפרק וחלקה מופרש אל מחוץ לגוף. אמנם במתן פסיבי של חלקיקים לא מדובר ביעילות של 100 אחוז אך עדיין קיים שיפור ניכר באחוז התרופה המגיעה לתא הסרטני (עד פי 10 ביחס לתרופה החופשית).
דרך שנייה היא הדרך האקטיבית – או במילים אחרות "סיכול ממוקד". נוסף על היכולת של תאי הסרטן ליצור כלי דם חדשים סביבם, פני שטח תא הסרטן כוללים מאפיינים ייחודיים. יש בהם מולקולות ביולוגיות אשר לא נמצאות על תאים תקינים (וביתר דיוק: הן נמצאות, אך מספרן נמוך מאוד). כמו כן התא הסרטני מעוטר בסמנים ביולוגיים הייחודיים רק לו. סמנים אלו משמשים כמנעולים – מעין קולטנים המאפשרים לנשאי התרופות החלקיקיים להכירם באופן ספציפי, להתביית ולהיקשר אליהם בתהליך זיהוי ספציפי, כמו שמפתח מתאים למנעול.
בתהליך של תגובה כימית מבוקרת במעבדה, אנו בוחרים ומדביקים על פני הליפוזומים שלנו את ה"בולים הביולוגיים" המתאימים ביותר לסוג התא שאליו אנו מעוניינים לכוון את החלקיקים המובילים את התרופה. הנוגדנים מסוגלים לזהות ולהיקשר אך ורק לאותו מנעול ספציפי, המצוי בשפע על גבי התאים הסרטניים, ובכך לשמש כטיל מונחה המעביר את התרופה ליעדה. המונח "כדור הקסם" שאותו טבע ארליך לפני יותר מ־100 שנים, המתאר חלקיק אידיאלי שישמש לריפוי מחלות, נמצא בבסיס הרעיון של ההכוונה הספציפית של ליפוזומים בעזרת נוגדנים הקשורים אליהם, נגד מטרה ספציפית כגון תא סרטני, וללא גרימת נזק לתאים שמסביב. לאחר קישור הנוגדן לקולטן המתאים, תתפרק המעטפת השומנית של הליפוזום בהדרגה והתרופה תשתחרר באופן מבוקר לתוך התא בדומה לתהליך השחרור הפסיבי.
אפשר לשלוט על כל אחד ממרכיבי הליפוזום ולתכנן את הֶרכב הנשא, את גודלו ואת סוג התרופה שתיכלא בתוכו. כמו כן אפשר לשלב כמה תרופות שונות כדי להגביר את יעילות הטיפול וכדי לשלוט בקצב שחרור התרופה בהתאם לפרופיל המחלה. כך מתאפשרת רפואה מותאמת אישית. קיים שוני ביולוגי בין חולים שונים המשפיע על פרופיל המחלה מחולה אחד לאחר. שונות זו היא שגורמת לחולים שונים להגיב בצורה שונה לאותו הטיפול. יש צורך להתאים את סוג הטיפול לחולה ולא להפך – כך אפשר ליצור דור חדש של תרופות מבוססות ליפוזומים, בעלי הרכב ייחודי ושונות ביולוגית המותאמים לטיפול אישי, על פי פרופיל החולה ושלבי המחלה.
משחקי הגנה והתקפה בגוף
יתרון נוסף של הליפוזומים טמון באופן הכנתם – שנעשה מחומרים טבעיים, ומגודלם, שבו אפשר לשלוט. מדוע זה חשוב? כי שני גורמים אלו מאפשרים להם לחמוק ממערך ההגנה המתוחכם של גופנו – מערכת החיסון, המגנה עלינו מפולשים זרים. מאחר שהליפוזומים אינם מזוהים כאויבים, המערכת לא משמידה אותם בהיכנסם לגוף, והם יכולים להישאר בזרם הדם זמן ממושך יחסית, להגיע ליעדם ולהשפיע. לאחר שסיימו את תפקידם הם יעברו פירוק בגוף, יפונו ממנו או יעברו ספיגה עצמית. מאחר שמדובר בדרך טיפול יעילה הרבה יותר ביחס לטיפול בתרופה חופשית, אפשר להפחית את המינון ובכך לצמצם את תופעות לוואי שונות, כמו נשירת שיער, בחילות, הקאות, רעילוּת לכליות, לכבד, לריאות ולפגיעה במערכת החיסון.
התחכמות נוספת המאפשרת להחדיר את "הסוסים הטרויאנים" שלנו לתוך הגוף, היא באמצעות חיפויים במעטפת המבוססת על סוכרים בעלי יכולת הכרה ספציפית לתאים סרטניים. לסוכרים תפקיד כפול – הם מאפשרים התחמקות ממערכת החיסון, מאחר שהפולימר הסוכרי לא מזוהה כחומר זר ולכן לא מושמד; נוסף על כך, לסוכרים שונים קולטנים הנמצאים בשפע על חלק גדול משטח הפָּנים של גידולים סרטניים, וכך הם גם משמשים כאמצעי קישור ספציפי לתאי הגידול.
לא תמיד אפשר לחצות מחסומים ביולוגיים כמו קרומיות התאים, גם כשמדובר בחלקיקים קטנים שגודלם אינו עולה על עשרות מיקרונים. דוגמה לכך היא המחסום דם־מוח, המגן על המוח מפני מזהמים. במקרה זה אפשר גם להזריק את החלקיקים ישירות לאזור הגידול. החלקיקים ייקשרו לקולטנים ועם הזמן ישחררו באופן מבוקר את התרופה אשר תחלחל אל תוך תאי הגידול ותשמיד אותם.
אבחון מוקדם ויעיל
שיטות מקובלת כיום לזיהוי מוקדם של סרטן מבוססת על בדיקות CT ו־MRI. התאים הסרטניים תאבים לסוכר הרבה יותר מאשר תאים תקינים, וכשמזריקים סוכר מסומן בחומר רדיואקטיבי לגוף הוא ייבלע קודם כל על ידי גידולים סרטניים, אם כאלה קיימים. אך שיטות אלו מוגבלות בשל רגישותם – יש צורך בריכוז גבוה של תאים כדי לאתרם באמצעות טכניקות אלו. סוגי סרטן מסוימים, כגון סרטני דם, סרטן הלבלב וסרטן השחלות, קשים מאוד לאבחון מוקדם. לעומת זאת, באמצעות ציפוי ליפוזומים בנוגדנים, אפשר בו בזמן לזהות, להתביית ולטפל בתאי הגידול! דרך זו, המשלבת בה בעת אבחון וטיפול נקראת תֶרָנוֹסטיקה (שילוב של ריפוי, תרפויטיקה וזיהוי דיאגנוסטיקה), וזהו תחום הנמצא בחזית המחקר הננו־רפואי וממקד אליו הרבה תשומת לב. היתרון הדיאגנוסטי הוא שהליפוזומים המצופים בנוגדנים מסוגלים לזהות גם מספר קטן של תאים סרטניים אשר בבדיקות קונבנציונליות לא היו מזוהים. הנוגדנים יהוו את אמצעי הזיהוי שישמש הן לגילוי מוקדם והן לריפוי, מאחר שאחרי הקישור למטרה תשוחרר התרופה הנמצאת בתוך החלקיקים. יהיה אפשר להשתמש בנוגדנים אלו כסמנים דיאגנוסטיים לזיהוי מוקדם ולמעקב אחר התקדמות המחלה. כמו כן אפשר להצמיד אליהם חומרים מתאימים (דוגמת חומרים רדיואקטיביים) ולעקוב אחריהם בעזרת בדיקות דימות, כמוCT .
חשוב להדגיש כי דווקא בתחום הננו־רפואה לא מדובר אך רק בתרופות ניסיוניות הנמצאות בשלבי מחקר ופיתוח. כיום קיימות כעשר תרופות מבוססות ליפוזומים לטיפול בסרטן; בין היתר לטיפול בסרטן שד, סרטן השחלות, Kaposis Sarcoma ו־multiple myeloma.
מהנעשה בשטח (המעבדה)
במעבדה אנו מתמקדים בעיקר בפיתוח גישות חדשניות המבוססות על חלקיקים לצורכי זיהוי וטיפול בסוגי סרטן שונים (סרטני דם, סרטני ריאות מוח ושחלות), לטיפול בדלקות מעיים כרוניות כגון מחלת קרוהן, וליצירת נשאים בגודל ננומטרי לטיפול במחלות נוירודגנרטיביות. אנו מנסים לפתח שיטות ריפוי חדשניות, יעילות יותר ורעילות פחות. כמה מחקרים במעבדה מתמקדים במולקולות ביולוגיות המיוצרות באופן טבעי בתוך תאי גופנו, שהן כשלעצמן מסוגלות להשמיד תאים או להצילם. הרעיון הוא לחקות את המנגנונים הביולוגיים הקיימים בגוף, לסנתז את אותן מולקולות ולהשתמש בהן כ"נשק ביולוגי". מולקולות קצרות אלו נקראות רנ"א־משתיק. מדובר בחומצות גרעין המיוצרות בתוך תאי הגוף ומשמשות כבקרה של תהליכים תאיים, כמו ירידה ברמת הביטוי של גנים מסוימים, מצב הנחוץ במצבי עקה ובהתקפות של נגיפים על תאי הגוף. אלא שמולקולות ערומות אלו, המיוצרות באופן סינטטי ומוחדרות אל זרם הדם, רגישות מאוד ועוברות פירוק מהיר בגוף ולכן לא תצלחנה לעבור את קרומיות התאים ולחדור לתוכם. לכן יש צורך בליפוזומים, שיעטפו אותן, וכך יגנו עליהן מפני פירוק ויאפשרו להן לחצות ביעילות את קרומיות התאים. על ידי שימוש במולקולות אלו אפשר להשמיד את התאים הפגומים.
אפשר גם להשתמש במולקולות ביולוגיות מסוג רנ"א־שליח, המשמשות כתבנית לייצור חלבונים. פגם בתהליך ייצור של חלבון יכול לגרום למחלה. במקרה זה הכנסה של מולקולה תקינה לתא במקום המולקולה הפגומה תוביל לייצור תקין של חלבון ויכולה להציל חיים או לשפר משמעותית את חיי החולה. תחום הטיפול באמצעות מולקולות ביולוגיות, המשלב טיפול יעיל וממוקד יותר במחלה, נמצא בצמיחה אדירה, ופוטנציאל הריפוי על ידי נשאים מבוססי ליפוזומים ממקד את תשומת הלב של חברות התרופות הגדולות.
פנינו לעתיד טוב יותר ?
התשובה היא כן – אך לא כל כך מהר. כיום אנו נמצאים בשלבי מחקר מתקדמים בחלק מהתרופות שאנו מפתחים. כל מחקר בנפרד מצריך ניסיונות רבים, תכנון מוקפד, חזרות על כל ניסוי כדי להוכיח יעילות והדירות גבוהים וביקורות נכונות. מאחר שמדובר בתרופות ניסיוניות לבני אדם, חלה עלינו החובה להוכיח כי התרופה אינה רעילה. רעילות היא מושג רחב ומורכב.יש צורך בניסויי רעילות שיוכיחו כי החלקיקים אינם רעילים. בניסויים אלו בודקים פרמטרים רבים מאוד, במגוון מודלים תאיים וכן בחיות. מדובר בעבודת מעבדה רבה הנמשכת שנים.
לסיכום, לתרופות המבוססות על ננוטכנולוגיה כמה יתרונות שלא קיימים במתן של תרופה חופשית: החומר הפעיל משתחרר בצורה מבוקרת לאורך זמן ולכן טווח ההשפעה שלו ארוך יותר מתרופה הניתנת באופן חופשי. כמו כן מאחר שמדובר במתן ממוקד של התרופה, תופעות הלוואי פחותות ביחס למתן תרופה חופשית.
אנו צופים כי בעתיד הלא רחוק תרופות רבות, המבוססות על ננו־חלקיקים בכלל, ועל ליפוזומים בפרט יחליפו ו/או ישולבו בטיפולים במחלות שונות, ובכך ישפרו את סיכויי ההחלמה ויאריכו את חיי החולים. נוסף על כך, אנו מודעים לכך שלכל אדם פרופיל גנטי שונה, כלומר, ייתכן שנצטרך לא רק לתפור את התרופה המתאימה אלה גם את הנשא המתאים לחולה. זאת נוכל לעשות ברפואה המותאמת באופן אישי.
ד"ר דלית לנדסמן מלוא היא חוקרת במעבדה לננו־רפואה באוניברסיטת תל־אביב ומנהלת מחקר בתחום הכוונת נשאי תרופות לגידולים סרטניים.
דן פאר הוא פרופ' במחלקה לחקר התא ואימונולוגיה וראש המעבדה לננו־רפואה במרכז לננו־טכנולוגיה באוניברסיטת תל־אביב.

